Investir
Achetez votre dispositif de validation Ellab et effectuez vos études par vous-même, à votre rythme et où que vous soyez.
Location
Louez vos équipements de validation et testez nos produits avant de les acheter.
Prestations de service sur site
Faites appel à nos ingénieurs pour réaliser vos qualification et validation sur site.
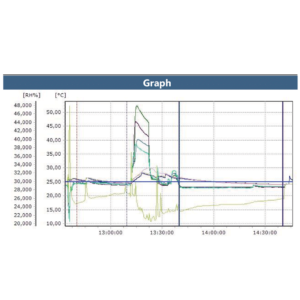
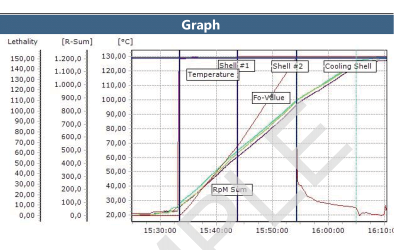
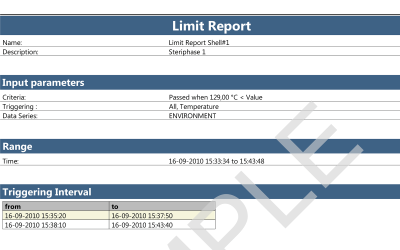
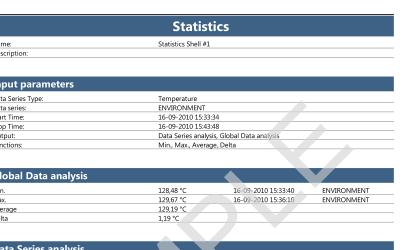
Rapports du logiciel ValSuite®
Chambre de stabilité